| |
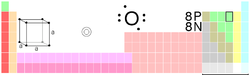
| Keterangan Umum Unsur |
| Nama, Lambang, Nomor atom | oksigen, O, 8 |
| Deret kimia | non-logam |
| Golongan, Periode, Blok | 16, 2, p |
| Penampilan | tak berwarna
 |
| Massa atom | 15,9994(3) g/mol |
| Konfigurasi elektron | 1s2 2s2 2p4 |
| Jumlah elektron tiap kulit | 2, 6 |
| Ciri-ciri fisik |
| Fase | gas |
| Massa jenis | (0 °C; 101,325 kPa)
1,429 g/L |
| Titik lebur | 54,36 K
(-218,79 °C, -361,82 °F) |
| Titik didih | 90,20 K
(-182,95 °C, -297,31 °F) |
| Kalor peleburan | (O2) 0,444 kJ/mol |
| Kalor penguapan | (O2) 6,82 kJ/mol |
| Kapasitas kalor | (25 °C) (O2)
29,378 J/(mol·K) |
Tekanan uap
| P/Pa | 1 | 10 | 100 | 1 k | 10 k | 100 k |
| pada T/K | | | | 61 | 73 | 90 |
|
| Ciri-ciri atom |
| Struktur kristal | kubus |
| Bilangan oksidasi | −2, −1
(oksida netral) |
| Elektronegativitas | 3,44 (skala Pauling) |
| Energi ionisasi | pertama: 1313,9 kJ/mol |
| ke-2: 3388,3 kJ/mol |
| ke-3: 5300,5 kJ/mol |
| Jari-jari atom | 60 pm |
| Jari-jari atom (terhitung) | 48 pm |
| Jari-jari kovalen | 73 pm |
| Jari-jari Van der Waals | 152 pm |
| Lain-lain |
| Sifat magnetik | paramagnetik |
| Konduktivitas termal | (300 K) 26,58 mW/(m·K) |
| Kecepatan suara | (gas, 27 °C) 330 m/s |
| Isotop |
| |
| Referensi |
Oksigen atau
zat asam adalah
unsur kimia dalam sistem
tabel periodik yang mempunyai lambang
O dan
nomor atom 8. Ia merupakan unsur golongan
kalkogen dan dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi
oksida). Pada
Temperatur dan tekanan standar, dua atom unsur ini
berikatan menjadi dioksigen, yaitu senyawa gas
diatomik dengan rumus
O2 yang tidak berwarna, tidak berasa, dan tidak berbau. Oksigen merupakan unsur
paling melimpah ketiga di alam semesta berdasarkan massa
dan unsur paling melimpah di
kerak Bumi. Gas oksigen diatomik mengisi 20,9% volume atmosfer bumi..
Semua kelompok molekul struktural yang terdapat pada organisme hidup, seperti
protein,
karbohidrat, dan
lemak, mengandung oksigen. Demikian pula
senyawa anorganik yang terdapat pada cangkang, gigi, dan tulang hewan. Oksigen dalam bentuk
O2 dihasilkan dari air oleh
sianobakteri,
ganggang, dan tumbuhan selama
fotosintesis, dan digunakan pada
respirasi sel oleh hampir semua makhluk hidup. Oksigen beracun bagi organisme
anaerob, yang merupakan bentuk kehidupan paling dominan pada masa-masa awal evolusi kehidupan.
O2 kemudian mulai berakumulasi pada atomsfer sekitar 2,5 milyar tahun yang lalu. Terdapat pula
alotrop oksigen lainnya, yaitu
ozon (
O3).
Lapisan ozon pada atomsfer membantu melindungi
biosfer dari
radiasi ultraviolet, namun pada permukaan bumi ia adalah polutan yang merupakan produk samping dari
asbut.
Oksigen secara terpisah ditemukan oleh
Carl Wilhelm Scheele di
Uppsala pada tahun 1773 dan
Joseph Priestley di
Wiltshire pada tahun 1774. Temuan Priestley lebih terkenal oleh karena publikasinya merupakan yang pertama kali dicetak. Istilah
oxygen diciptakan oleh
Antoine Lavoisier pada tahun 1777, yang eksperimennya dengan oksigen berhasil meruntuhkan
teori flogiston pembakaran dan
korosi yang terkenal. Oksigen secara industri dihasilkan dengan
distilasi bertingkat udara cair, dengan munggunakan
zeolit untuk memisahkan
karbon dioksida dan
nitrogen dari udara, ataupun
elektrolisis air, dll. Oksigen digunakan dalam produksi baja, plastik, dan tekstil, ia juga digunakan sebagai
propelan roket, untuk
terapi oksigen, dan sebagai penyokong kehidupan pada
pesawat terbang,
kapal selam,
penerbangan luar angkasa, dan
penyelaman.
Karakteristik
Struktur
Pada
temperatur dan tekanan standar, oksigen berupa gas tak berwarna dan tak berasa dengan rumus kimia
O2, di mana dua atom oksigen secara kimiawi berikatan dengan
konfigurasi elektron triplet spin. Ikatan ini memiliki
orde ikatan dua dan sering dijelaskan secara sederhana sebagai
ikatan ganda ataupun sebagai kombinasi satu ikatan dua elektron dengan dua ikatan tiga elektron.
Oksigen triplet merupakan
keadaan dasar molekul
O2. Konfigurasi elektron molekul ini memiliki dua elektron tak berpasangan yang menduduki dua
orbital molekul yang berdegenerasi. Kedua orbital ini dikelompokkan sebagai
antiikat (melemahkan orde ikatan dari tiga menjadi dua), sehingga ikatan oksigen diatomik adalah lebih lemah daripada ikatan rangkap tiga
nitrogen.
Dalam bentuk triplet yang normal, molekul
O2 bersifat
paramagnetik oleh karena
spin momen magnetik elektron tak berpasangan molekul tersebut dan
energi pertukaran negatif antara molekul
O2 yang bersebelahan. Oksigen cair akan tertarik kepada
magnet, sedemikiannya pada percobaan laboratorium, jembatan oksigen cair akan terbentuk di antara dua kutub magnet kuat.
Oksigen singlet, adalah nama molekul oksigen
O2 yang kesemuaan spin elektronnya berpasangan. Ia lebih reaktif terhadap
molekul organik pada umumnya. Secara alami, oksigen singlet umumnya dihasilkan dari air selama fotosintesis. Ia juga dihasilkan di
troposfer melalui fotolisis ozon oleh sinar berpanjang gelombang pendek, dan oleh sistem kekebalan tubuh sebagai sumber oksigen aktif.
[14] Karotenoid pada organisme yang berfotosintesis (kemungkinan juga ada pada hewan) memainkan peran yang penting dalam menyerap oksigen singlet dan mengubahnya menjadi berkeadaan dasar tak tereksitasi sebelum ia menyebabkan kerusakan pada jaringan.

Ozon merupakan gas langka pada bumi yang dapat ditemukan di
stratosfer.
Alotrop
Alotrop oksigen elementer yang umumnya ditemukan di bumi adalah dioksigen
O2. Ia memiliki panjang ikat 121
pm dan energi ikat 498
kJ·mol-1. Altrop oksigen ini digunakan oleh makhluk hidup dalam
respirasi sel dan merupakan komponen utama atmosfer bumi.
Trioksigen (
O3), dikenal sebagai
ozon, merupakan alotrop oksigen yang sangat reaktif dan dapat merusak jaringan paru-paru. Ozon diproduksi di atmosfer bumi ketika
O2 bergabung dengan oksigen atomik yang dihasilkan dari pemisahan
O2 oleh radiasi
ultraviolet (UV). Oleh karena ozon menyerap gelombang UV dengan sangat kuat,
lapisan ozon yang berada di atmosfer berfungsi sebagai perisai radiasi yang melindungi planet. Namun, dekat permukaan bumi, ozon merupakan polutan udara yang dibentuk dari produk sampingan pembakaran otomobil.
Molekul
metastabil tetraoksigen (
O4) ditemukan pada tahun 2001, dan diasumsikan terdapat pada salah satu enam fase
oksigen padat. Hal ini dibuktikan pada tahun 2006, dengan menekan
O2 sampai dengan 20
GPa, dan ditemukan struktur gerombol
rombohedral O8. Gerombol ini berpotensi sebagai
oksidator yang lebih kuat daripada
O2 maupun
O3, dan dapat digunakan dalam
bahan bakar roket.
[19][20] Fase logam oksigen ditemukan pada tahun 1990 ketika oksigen padat ditekan sampai di atas 96 GPa. Ditemukan pula pada tahun 1998 bahwa pada suhu yang sangat rendah, fase ini menjadi
superkonduktor.
Sifat fisik

Warna oksigen cair adalah biru seperti warna biru langit. Fenomena ini tidak berkaitan; warna biru langit disebabkan oleh
penyebaran Rayleigh.
Oksigen lebih
larut dalam air daripada nitrogen. Air mengandung sekitar satu molekul
O2 untuk setiap dua molekul
N2, bandingkan dengan rasio atmosferik yang sekitar 1:4. Kelarutan oksigen dalam air bergantung pada suhu. Pada suhu 0 °C, konsentrasi oksigen dalam air adalah 14,6 mg·L
−1, manakala pada suhu 20 °C oksigen yang larut adalah sekitar 7,6 mg·L
−1. Pada suhu 25 °C dan 1
atm udara, air tawar mengandung 6,04
mililiter (mL) oksigen per
liter, manakala dalam
air laut mengandung sekitar 4,95 mL per liter. Pada suhu 5 °C, kelarutannya bertambah menjadi 9,0 mL (50% lebih banyak daripada 25 °C) per liter untuk air murni dan 7,2 mL (45% lebih) per liter untuk air laut.
Oksigen mengembun pada 90,20
K (−182,95 °C, −297,31 °F), dan membeku pada 54.36 K (−218,79 °C, −361,82 °F). Baik oksigen cair dan oksigen padat berwarna biru langit. Hal ini dikarenakan oleh penyerapan warna merah. Oksigen cair dengan kadar kemurnian yang tinggi biasanya didapatkan dengan
distilasi bertingkat udara cair; Oksigen cair juga dapat dihasilkan dari pengembunan udara, menggunakan nitrogen cair dengan pendingin. Oksigen merupakan zat yang sangat reaktif dan harus dipisahkan dari bahan-bahan yang mudah terbakar.
Isotop
Oksigen yang dapat ditemukan secara alami adalah
16O,
17O, dan
18O, dengan
16O merupakan yang paling melimpah (99,762%).Isotop oksigen dapat berkisar dari yang ber
nomor massa 12 sampai dengan 28.
Kebanyakan
16O di
disintesis pada akhir proses
fusi helium pada
bintang, namun ada juga beberapa yang dihasilkan pada proses pembakaran neon.
17O utamanya dihasilkan dari pembakaran hidrogen menjadi
helium semasa
siklus CNO, membuatnya menjadi isotop yang paling umum pada zona pembakaran hidrogen bintang. Kebanyakan
18O diproduksi ketika
14N (berasal dari pembakaran CNO) menangkap inti
4He, menjadikannya bentuk isotop yang paling umum di zona kaya helium bintang.
Empat belas
radioisotop telah berhasil dikarakterisasi, yang paling stabil adalah
15O dengan
umur paruh 122,24 detik dan
14O dengan umur paruh 70,606 detik. Isotop radioaktif sisanya memiliki umur paruh yang lebih pendek daripada 27 detik, dan mayoritas memiliki umur paruh kurang dari 83 milidetik.
Modus peluruhan yang paling umum untuk isotop yang lebih ringan dari
16O adalah
penangkapan elektron, menghasilkan nitrogen, sedangkan modus peluruhan yang paling umum untuk isotop yang lebih berat daripada
18O adalah
peluruhan beta, menghasilkan
fluorin.
Keberadaan
Menurut massanya, oksigen merupakan unsur kimia paling melimpah di biosfer, udara, laut, dan tanah bumi. Oksigen merupakan unsur kimia paling melimpah ketiga di alam semesta, setelah hidrogen dan helium. Sekitar 0,9% massa
Matahari adalah oksigen. Oksigen mengisi sekitar 49,2% massa
kerak bumi dan merupakan komponen utama dalam samudera (88,8% berdasarkan massa). Gas oksigen merupakan komponen paling umum kedua dalam
atmosfer bumi, menduduki 21,0% volume dan 23,1% massa (sekitar 10
15 ton) atmosfer. Bumi memiliki ketidaklaziman pada atmosfernya dibandingkan planet-planet lainnya dalam
sistem tata surya karena ia memiliki konsentrasi gas oksigen yang tinggi di atmosfernya. Bandingkan dengan
Mars yang hanya memiliki 0,1%
O2 berdasarkan volume dan
Venus yang bahkan memiliki kadar konsentrasi yang lebih rendah. Namun,
O2 yang berada di planet-planet selain bumi hanya dihasilkan dari radiasi ultraviolet yang menimpa molekul-molekul beratom oksigen, misalnya
karbon dioksida.

Air dingin melarutkan lebih banyak O2.
Konsentrasi gas oksigen di Bumi yang tidak lazim ini merupakan akibat dari
siklus oksigen.
Siklus biogeokimia ini menjelaskan pergerakan oksigen di dalam dan di antara tiga reservoir utama bumi: atmosfer,
biosfer, dan
litosfer. Faktor utama yang mendorong siklus oksigen ini adalah
fotosintesis. Fotosintesis melepaskan oksigen ke atmosfer, manakala
respirasi dan proses
pembusukan menghilangkannya dari atmosfer. Dalam keadaan
kesetimbangan, laju produksi dan konsumsi oksigen adalah sekitar 1/2000 keseluruhan oksigen yang ada di atmosfer setiap tahunnya.
Oksigen bebas juga terdapat dalam air sebagai larutan. Peningkatan kelarutan
O2 pada temperatur yang rendah memiliki implikasi yang besar pada kehidupan laut. Lautan di sekitar kutub bumi dapat menyokong kehidupan laut yang lebih banyak oleh karena kandungan oksigen yang lebih tinggi.
Air yang terkena polusi dapat mengurangi jumlah
O2 dalam air tersebut. Para ilmuwan menaksir kualitas air dengan mengukur
kebutuhan oksigen biologis atau jumlah
O2 yang diperlukan untuk mengembalikan konsentrasi oksigen dalam air itu seperti semula.
Peranan biologis
Fotosintesis dan respirasi
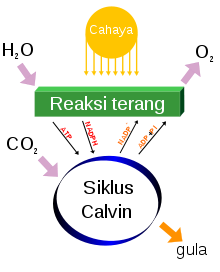
Fotosintesis menghasilkan O2
Di alam, oksigen bebas dihasilkan dari
fotolisis air selama
fotosintesis oksigenik.
Ganggang hijau dan
sianobakteri di lingkungan lautan menghasilkan sekitar 70% oksigen bebas yang dihasilkan di bumi, sedangkan sisanya dihasilkan oleh tumbuhan daratan.
Persamaan kimia yang sederhana untuk fotosintesis adalah:
-
- 6CO2 + 6H2O + foton → C6H12O6 + 6O2
Evolusi oksigen fotolitik terjadi di
membran tilakoid organisme dan memerlukan energi empat
foton. Terdapat banyak langkah proses yang terlibat, namun hasilnya merupakan pembentukan gradien
proton di seluruh permukaan tilakod. Ini digunakan untuk mensintesis
ATP via
fotofosforilasi.
O2 yang dihasilkan sebagai produk sampingan kemudian dilepaskan ke atmosfer.
Dioksigen molekuler,
O2, sangatlah penting untuk
respirasi sel organisme aerob. Oksigen digunakan di
mitokondria untuk membantu menghasilkan
adenosina trifosfat (ATP) selama
fosforilasi oksidatif. Reaksi respirasi aerob ini secara garis besar merupakan kebalikan dari fotosintesis, secara sederhana:
-
- C6H12O6 + 6O2 → 6CO2 + 6H2O + 2880 kJ·mol-1
Pada
vetebrata,
O2 berdifusi melalui membran paru-paru dan dibawa oleh
sel darah merah.
Hemoglobin mengikat
O2, mengubah warnanya dari merah kebiruan menjadi merah cerah..Terdapat pula hewan lainnya yang menggunakan
hemosianin (hewan
moluska dan beberapa
antropoda) ataupun
hemeritrin (
laba-laba dan
lobster). Satu liter darah dapat melarutkan 200 cc
O2.
Spesi oksigen yang reaktif, misalnya ion
superoksida (O
2−) dan
hidrogen peroksida (
H2O2), adalah produk sampingan penggunaan oksigen dalam tubuh organisme. Namun, bagian
sistem kekebalan organisme tingkat tinggi pula menghasilkan peroksida, superoksida, dan oksigen singlet untuk menghancurkan mikroba. Spesi oksigen reaktif juga memainkan peran yang penting pada
respon hipersensitif tumbuhan melawan serangan patogen.
Dalam keadaan istirahai, manusia dewasa
menghirup 1,8 sampai 2,4 gram oksigen per menit.
Jumlah ini setara dengan 6 milyar ton oksigen yang dihirup oleh seluruh manusia per tahun.
Penumpukan oksigen di atmosfer

Peningkatan kadar O2 di atmosfer bumi: 1) tiada O2 yang dihasilkan; 2) O2 dihasilkan, namun diserap samudera dan batuan dasar laut; 3) O2 mulai melepaskan diri dari samuder, namun diserap oleh permukaan tanah dan pembentukan lapisan ozon; 4-5) gas O2 mulai berakumulasi
Gas oksigen bebas hampir tidak terdapat pada
atmosfer bumi sebelum munculnya
arkaea dan
bakteri fotosintetik. Oksigen bebas pertama kali muncul dalam kadar yang signifikan semasa masa
Paleoproterozoikum (antara 2,5 sampai dengan 1,6 milyar tahun yang lalu). Pertama-tama, oksigen bersamaan dengan
besi yang larut dalam samudera, membentuk formasi pita besi (
Banded iron formation). Oksigen mulai melepaskan diri dari samudera 2,7 milyar tahun lalu, dan mencapai 10% kadar sekarang sekitar 1,7 milyar tahun lalu.
Keberadaan oksigen dalam jumlah besar di atmosfer dan samudera kemungkinan membuat kebanyakan
organisme anaerob hampir
punah semasa
bencana oksigen sekitar 2,4 milyar tahun yang lalu. Namun,
respirasi sel yang menggunakan O
2 mengijinkan
organisme aerob untuk memproduksi lebih banyak ATP daripada organisme anaerob, sehingga organisme aerob mendominasi
biosfer bumi. Fotosintesis dan respirasi seluler
O2 mengijinkan berevolusinya
sel eukariota dan akhirnya berevolusi menjadi organisme multisel seperti tumbuhan dan hewan.
Sejak permulaan era
Kambrium 540 juta tahun yang lalu, kadar
O2 berfluktuasi antara 15% sampai 30% berdasarkan volume. Pada akhir masa
Karbon, kadar
O2 atmosfer mencapai maksimum dengan 35% berdasarkan volume, mengijinkan serangga dan amfibi tumbuh lebih besar daripada ukuran sekarang. Aktivitas manusia, meliputi pembakaran 7 milyar
ton bahan bakar fosil per tahun hanya memiliki pengaruh yang sangat kecil terhadap penurunan kadar oksigen di atmosfer. Dengan laju fotosintesis sekarang ini, diperlukan sekitar 2.000 tahun untuk memproduksi ulang seluruh
O2 yang ada di atmosfer sekarang.
Sejarah
Percobaan awal
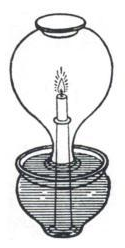
Percobaan Philo yang menginspirasi para peneliti selanjutnya
Salah satu percobaan pertama yang menginvestigasi hubungan antara
pembakaran dengan udara dilakukan oleh seorang penulis
Yunani abad ke-2,
Philo dari Bizantium. Dalam karyanya
Pneumatica, Philo mengamati bahwa dengan membalikkan labu yang di dalamnnya terdapat lilin yang menyala dan kemudian menutup leher labu dengan air akan mengakibatkan permukaan air yang terdapat dalam leher labu tersebut meningkat. Philo menyimpulkan bahwa sebagian udara dalam labu tersebut diubah menjadi unsur
api, sehingga dapat melepaskan diri dari labu melalui pori-pori kaca. Beberapa abad kemudian,
Leonardo da Vinci merancang eksperimen yang sama dan mengamati bahwa udara dikonsumsi selama pembakaran dan
respirasi.
Pada akhir abad ke-17,
Robert Boyle membuktikan bahwa udara diperlukan dalam proses pembakaran. Kimiawan Inggris,
John Mayow, melengkapi hasil kerja Boyle dengan menunjukkan bahwa hanya sebagian komponen udara yang ia sebut sebagai
spiritus nitroaereus atau
nitroaereus yang diperlukan dalam pembakaran. Pada satu eksperimen, ia menemukan bahwa dengan memasukkan seekor tikus ataupun sebatang lilin ke dalam wadah penampung yang tertutup oleh permukaan air akan mengakibatkan permukaan air tersebut naik dan menggantikan seperempatbelas volume udara yang hilang. Dari percobaan ini, ia menyimpulkan bahwa
nitroaereus digunakan dalam proses
respirasi dan
pembakaran.
Mayow mengamati bahwa berat
antimon akan meningkat ketika dipanaskan. Ia menyimpulkan bahwa
nitroaereus haruslah telah bergabung dengan antimon. Ia juga mengira bahwa paru-para memisahkan
nitroaereus dari udara dan menghantarkannya ke dalam darah, dan panas tubuh hewan serta pergerakan otot akan mengakibatkan reaksi
nitroaereus dengan zat-zat tertentu dalam tubuh. Laporan seperti ini dan pemikiran-pemikiran serta percobaan-percobaan lainnya dipublikasikan pada tahun 1668 dalam karyanya
Tractatus duo pada bagian "De respiratione".
Teori flogiston

Stahl membantu mengembangkan dan mempopulerkan teori flogiston.
Dalam percobaan
Robert Hooke,
Ole Borch,
Mikhail Lomonosov, dan Pierre Bayen, percobaan mereka semuanya menghasilkan oksigen, namun tiada satupun dari mereka yang mengenalinya sebagai unsur. Hal ini kemungkinan besar disebabkan oleh prevalensi filosofi
pembakaran dan
korosi yang dikenal sebagai teori flogiston.
Teori flogiston dikemukakan oleh alkimiawan Jerman,
J. J. Becher pada tahun 1667, dan dimodifikasi oleh kimiawan
Georg Ernst Stahl pada tahun 1731. Teori flogiston menyatakan bahwa semua bahan yang dapat terbakar terbuat dari dua bagian komponen. Salah satunya adalah flogiston, yang dilepaskan ketika bahan tersebut dibakar, sedangkan bagian yang tersisa setelah terbakar merupakan bentuk asli materi tersebut.
Bahan-bahan yang terbakar dengan hebat dan meninggalkan sedikit residu (misalnya kayu dan batu bara), dianggap memiliki kadar flogiston yang sangat tinggi, sedangkan bahan-bahan yang tidak mudah terbakar dan berkorosi (misalnya besi), mengandung sangat sedikit flogiston. Udara tidak memiliki peranan dalam teori flogiston. Tiada eksperimen kuantitatif yang pernah dilakukan untuk menguji keabsahan teori flogiston ini, melainkan teori ini hanya didasarkan pada pengamatan bahwa ketika sesuatu terbakar, kebanyakan objek tampaknya menjadi lebih ringan dan sepertinya kehilangan sesuatu selama proses pembakaran tersebut. Fakta bahwa materi seperti kayu sebenarnya
bertambah berat dalam proses pembakaran tertutup oleh gaya apung yang dimiliki oleh produk pembakaran yang berupa gas tersebut. Sebenarnya pun, fakta bahwa logam akan bertambah berat ketika berkarat menjadi petunjuk awal bahwa teori flogiston tidaklah benar (yang mana menurut teori flogiston, logam tersebut akan menjadi lebih ringan).

Carl Wilhelm Scheele mendahului Priestley dalam penemuan oksigen, namun publikasinya dilakukan setelah Priestley.
Penemuan
Oksigen pertama kali ditemukan oleh seorang ahli obat
Carl Wilhelm Scheele. Ia menghasilkan gas oksigen dengan mamanaskan raksa oksida dan berbagai nitrat sekitar tahun 1772. Scheele menyebut gas ini 'udara api' karena ia murupakan satu-satunya gas yang diketahui mendukung pembakaran. Ia menuliskan pengamatannya ke dalam sebuah manuskrip yang berjudul
Treatise on Air and Fire, yang kemudian ia kirimkan ke penerbitnya pada tahun 1775. Namun, dokumen ini tidak dipublikasikan sampai dengan tahun 1777.
Pada saat yang sama, seorang pastor
Britania,
Joseph Priestley, melakukan percobaan yang memfokuskan cahaya matahari ke
raksa oksida (HgO) dalam tabung gelas pada tanggal 1 Augustus 1774. Percobaan ini menghasilkan gas yang ia namakan 'dephlogisticated air'.
[3] Ia mencatat bahwa lilin akan menyala lebih terang di dalam gas tersebut dan seekor tikus akan menjadi lebih aktif dan hidup lebih lama ketika menghirup udara tersebut. Setelah mencoba menghirup gas itu sendiri, ia menulis: "The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards." Priestley mempublikasikan penemuannya pada tahun 1775 dalam sebuah laporan yang berjudul "An Account of Further Discoveries in Air". Laporan ini pula dimasukkan ke dalam jilid kedua bukunya yang berjudul
Experiments and Observations on Different Kinds of Air. Oleh karena ia mempublikasikan penemuannya terlebih dahulu, Priestley biasanya diberikan prioritas terlebih dahulu dalam penemuan oksigen.
Seorang kimiawan Perancis,
Antoine Laurent Lavoisier kemudian mengklaim bahwa ia telah menemukan zat baru secara independen. Namun, Priestley mengunjungi Lavoisier pada Oktober 1774 dan memberitahukan Lavoisier mengenai eksperimennya serta bagaimana ia menghasilkan gas baru tersebut. Scheele juga mengirimkan sebuah surat kepada Lavoisier pada 30 September 1774 yang menjelaskan penemuannya mengenai zat yang tak diketahui, tetapi Lavoisier tidak pernah mengakui menerima surat tersebut (sebuah kopian surat ini ditemukan dalam barang-barang pribadi Scheele setelah kematiannya).
Kontribusi Lavoisier
Apa yang Lavoisier tidak terbantahkan pernah lakukan (walaupun pada saat itu dipertentangkan) adalah percobaan kuantitatif pertama mengenai
oksidasi yang mengantarkannya kepada penjelasan bagaimana proses pembakaran bekerja. Ia menggunakan percobaan ini beserta percobaan yang mirip lainnya untuk meruntuhkan teori flogiston dan membuktikan bahwa zat yang ditemukan oleh Priestley dan Scheele adalah
unsur kimia.
Pada satu eksperimen, Lavoisier mengamati bahwa tidak terdapat keseluruhan peningkatan berat ketika
timah dan udara dipanaskan di dalam wadah tertutup. Ia mencatat bahwa udara segera masuk ke dalam wadah seketika ia membuka wadah tersebut. Hal ini mengindikasikan bahwa sebagian udara yang berada dalam wadah tersebut telah dikonsumsi. Ia juga mencatat bahwa berat timah tersebut juga telah meningkat dan jumlah peningkatan ini adalah sama beratnya dengan udara yang masuk ke dalam wadah tersebut. Percobaan ini beserta percobaan mengenai pembakaran lainnya didokumentasikan ke dalam bukunya
Sur la combustion en général yang dipublikasikan pada tahun 1777. Hasil kerjanya membuktikan bahwa udara merupakan campuran dua gas, 'udara vital', yang diperlukan dalam pembakaran dan respirasi, serta
azote (Bahasa Yunani
ἄζωτον "tak bernyawa"), yang tidak mendukung pembakaran maupun respirasi.
Azote kemudian menjadi apa yang dinamakan sebagai
nitrogen, walaupun dalam Bahasa Perancis dan beberapa bahasa Eropa lainnya masih menggunakan nama
Azote.
Lavoisier menamai ulang 'udara vital' tersebut menjadi
oxygène pada tahun 1777. Nama tersebut berasal dari akar kata
Yunani ὀξύς (oxys) (
asam, secara harfiah "tajam") dan
-γενής (-genēs) (penghasil, secara harfiah penghasil keturunan). Ia menamainya demikian karena ia percaya bahwa oksigen merupakan komponen dari semua asam. Ini tidaklah benar, namun pada saat para kimiawan menemukan kesalahan ini, nama
oxygène telah digunakan secara luas dan sudah terlambat untuk menggantinya. Sebenarnya gas yang lebih tepat untuk disebut sebagai "penghasil asam" adalah
hidrogen.
Oxygène kemudian diserap menjadi
oxygen dalam bahasa Inggris walaupun terdapat penentangan dari ilmuwan-ilmuwan Inggris dikarenakan bahwa adalah seorang Inggris, Priestley, yang pertama kali mengisolasi serta menuliskan keterangan mengenai gas ini. Penyerapan ini secara sebagian didorong oleh sebuah puisi berjudul "Oxygen" yang memuji gas ini dalam sebuah buku populer
The Botanic Garden (1791) oleh
Erasmus Darwin, kakek
Charles Darwin.
Sejarah selanjutnya

Robert H. Goddard dengan roket berbahan bakar campuran bensin dan oksigen cair rancangannya
Hipotesis atom awal
John Dalton berasumsi bahwa semua unsur berupa monoatomik dan atom-atom dalam suatu senyawa akan memiliki rasio atom paling sederhana terhadap satu sama lainnya. Sebagai contoh, Dalton berasumsi bahwa rumus air adalah HO, sehingga
massa atom oksigen adalah 8 kali massa hidrogen (nilai yang sebenarnya adalah 16). Pada tahun 1805,
Joseph Louis Gay-Lussac dan
Alexander von Humboldt menunjukkan bahwa air terbentuk dari dua volume hidrogen dengan satu volume oksigen; dan pada tahun 1811, berdasarkan apa yang sekarang disebut
hukum Avogadro dan asumsi molekul unsur diatomik,
Amedeo Avogadro memperkirakan komposisi air dengan benar.
Pada akhir abad ke-19, para ilmuwan menyadari bahwa udara dapat dicairkan dan komponen-komponennya dapat dipisahkan dengan mengkompres dan mendinginkannya. Kimiawan dan fisikawan Swiss,
Raoul Pierre Pictet, menguapkan cairan
sulfur dioksida untuk mencairkan
karbon dioksida, yang mana pada akhirnya diuapkan untuk mendinginkan gas oksigen menjadi cairan. Ia mengirim sebuah telegram pada 22 Desember 1877 kepada Akademi Sains Prancis di Paris dan mengumumkan penemuan
oksigen cairnya. Dua hari kemudian, fisikawan Perancis
Louis Paul Cailletet mengumumkan metodenya untuk mencairkan oksigen molekuler. Hanya beberapa tetes cairan yang dihasilkan sehingga tidak ada analisis berarti yang dapat dilaksanakan. Oksigen berhasil dicairkan ke dalam keadaan stabil untuk pertama kalinya pada 29 Maret 1877 oleh ilmuwan Polandia dari
Universitas Jagiellonian,
Zygmunt Wróblewski dan
Karol Olszewski.
Pada tahun 1891, kimiawan Skotlandia
James Dewar berhasil memproduksi oksigen cair dalam jumlah yang cukup banyak untuk dipelajari. Proses produksi oksigen cair secara komersial dikembangkan secara terpisah pada tahun 1895 oleh insinyur Jerman
Carl von Linde dan insinyur Britania William Hampson. Kedua insinyur tersebut menurunkan suhu udara sampai ia mencair dan kemudian mendistilasi udara cair tersebut. Pada tahun 1901, pengelasan oksiasetilena didemonstrasikan untuk pertama kalinya dengan membakar campuran
asetilena dan
O2 yang dimampatkan. Metode pengelasan dan pemotongan logam ini pada akhirnya digunakan secara meluas.
Pada tahun 1923, ilmuwan Amerika
Robert H. Goddard menjadi orang pertama yang mengembangkan
mesin roket; mesin ini menggunakan
bensin sebagai bahan bakar dan oksigen cair sebagai
oksidator. Goddard berhasil menerbangkan roket kecil sejauh 56 m dengan kecepatan 97 km/jam pada 16 Maret 1926 di
Auburn, Massachusetts, USA.
Senyawa oksigen

Air (
H2O) adalah senyawa oksigen yang paling dikenal.
Keadaan oksidasi okesigen adalah -2 untuk hampir semua senyawa oksigen yang diketahui. Keadaan oksidasi -1 ditemukan pada beberapa senyawa seperti
peroksida. Senyawa oksigen dengan keadaan oksidasi lainnya sangat jarang ditemukan, yakni -1/2 (
superoksida), -1/3 (
ozonida), 0 (
asam hipofluorit), +1/2 (
dioksigenil), +1 (
dioksigen difluorida), dan +2 (
oksigen difluorida).
[sunting] Senyawa oksida dan senyawa anorganik lainnya
Air (
H2O) adalah oksida
hidrogen dan merupakan senyawa oksigen yang paling dikenal. Atom hidrogen secara
kovalen berikatan dengan oksigen. Selain itu, atom hidrogen juga berinteraksi dengan atom oksigen dari molekul air lainnya (sekitar 23,3 kJ·mol
−1 per atom hidrogen).
Ikatan hidrogen antar molekul air ini menjaga kedua molekul 15% lebih dekat daripada yang diperkirakan apabila hanya memperhitungkan
gaya Van der Waals.

Senyawa oksida seperti
besi oksida atau karat terbentuk ketika oksigen bereaksi dengan unsur lainnya.
Oleh karena
elektronegativitasnya, oksigen akan membentuk
ikatan kimia dengan hampir semua unsur lainnya pada suhu tinggi dan menghasilkan senyawa
oksida. Namun, terdapat pula beberapa unsur yang secara spontan akan membentuk oksida pada suhu dan tekanan standar. Per
karatan besi merupakan salah satu contohnya. Permukaan logam seperti
aluminium dan
titanium teroksidasi dengan keberadaan udara dan membuat permukaan logam tersebut tertutupi oleh lapisan tipis oksida. Lapisan oksida ini akan mencegah korosi lebih lanjut. Beberapa senyawa oksida logam transisi ditemukan secara alami sebagai senyawa non-stoikiometris. Sebagai contohnya,
FeO (
wustit) sebenarnya berumus
Fe1 − xO, dengan
x biasanya sekitar 0,05.
Di atmosfer pula, kita dapat menemukan sejumlah kecil oksida karbon, yaitu
karbon dioksida (
CO2). Pada
kerak bumi pula dapat ditemukan berbagai senyawa oksida, yakni oksida silikon (
Silika SO2) yang ditemukan pada
granit dan
pasir, oksida aluminium (
aluminium oksida Al2O3 yang ditemukan pada
bauksit dan
korundum), dan oksida besi (
besi(III) oksida Fe2O3) yang ditemukan pada
hematit dan
karat logam.